水世界-中国城镇水网
www.chinacitywater.org

博才多学:亚硫酸盐失效原因及防止方法的研究
时间:2013-10-08 09:54:32 作者: 来源:
摘要通过模拟贮存试验,研究了亚硫酸盐失效原因及防止方法。结果表明,目前广泛应用的亚硫酸盐法防止氧腐蚀效果有时不佳的原因主要是亚硫酸盐溶液在贮存期间的自动氧化。水质和pH值等条件对自动氧化几乎没有影响,自由基引发剂能加速自动氧化,自由基吸收剂则使稳定性提高。试验结果为亚硫酸盐氧化的自由基机理提供了有力证据,也为亚硫酸盐的贮存失效提供了有效的防止方法。
亚硫酸盐是油田、锅炉和污水处理中广泛应用的氧腐蚀防止剂〔1,2〕。对其防腐效果有时不佳的原因普遍认为是与氧反应速度过慢所致〔3〕。虽然有意见认为可能是加入系统前氧化失效〔4~6〕,但缺乏实验论证。我们将通过模拟试验查明了亚硫酸盐的失效原因是贮存期间的自动氧化,得出失效防止方法及其理论依据。
亚硫酸盐空气氧化在250 mL玻璃烧杯中进行,试验液量200 mL。试验用亚硫酸盐为化学纯亚硫酸钠(SS)。SS的初始质量浓度为10%。催化亚硫酸盐CSS由分析纯五水硫酸铜和SS制得,催化剂用量为SS质量的1%。稳定亚硫酸盐SSS〔6〕由SS和自由基吸收剂Vc制得,稳定剂用量为SS质量的1.5%。实验用水为自来水(TW)及其软化水(SW)和去离子水(DW),其成分见表1。水质分析、SS含量测定及水中溶解氧的测定符合GB1576—1996标准。

2.1纯SS的氧化
当用去离子水配制溶液时,在不密封情况下,SS剩余浓度随时间变化的试验结果见图1。由于所用水几乎不含杂质,因而图1实际上是纯SS溶液受空气氧化的结果。随着存放时间的延长,溶液中SS含量大幅度下降,说明SS溶液在空气中很容易自动氧化。在本实验条件下,实验水溶液中溶解氧初始含量只有1.8 mg,按化学计量,这些溶解氧仅能消耗SS 14.18 mg,与SS实际损失相比仅占0.07%,而因空气氧化额外损失的部分则占99.93%。
2.2水质的影响
试验了不密封的SS溶液在不同水质下的氧化情况(见图2)。在所有情况下,SS随时间的消耗同采用去离子水时的情况差别不大。如果不考虑钠离子的影响,从软化水和去离子水的比较,可以看出水中阴离子对SS空气氧化的作用。比较自来水和软化水的实验结果,则可判断钙、镁离子的影响。实验结果说明,水中存在的普通阴离子和钙、镁等硬度成分离子,对SS的贮存氧化影响不大。
2.3贮器密封程度的影响
实验采用密封不严和不密封两种方法。显而易见,贮器密封不严比不密封时SS的耗量有所减少。在本实验条件下,贮器中SS溶液浓度很高,可认为溶液中没有残余溶解氧存在,SS空气氧化主要集中在SS溶液与空气接触的界面上进行,由于界面上SS量大大高于与之反应的氧气量,所以可以忽略SS传质过程对氧化速度的影响。在两种密封情况下,实验所用水质和SS相同,因此,可以忽略SS溶液吸氧速度的影响,则氧的供应速度和界面面积成为SS溶液空气氧化的主要控制因素。供氧速度和界面面积越大,空气氧化速度越快,而贮器密封不严比不密封时供氧速度和界面面积小得多。
2.4pH值的影响
当用近中性的去离子水、软化水和自来水配制SS溶液时,溶液的起始pH值较高,因为SS是一种弱酸强碱盐,在水中会按下式水解:
SO32-+H2OHSO3-+OH-
HSO3-+H2OH2SO3+OH-
随着SS的氧化消耗和硫酸钠的生成,溶液的pH值又逐渐降低至中性的水平。为了求得pH值作为单独因素的影响,试验了明显酸性、中性和碱性水质的作用,试验得知:氧和亚硫酸盐在三种pH值条件下的反应速度没有显著差别。在三种pH值下,SS水解生成的离子量是明显不同的。根据离解常数可以算出,在约25 ℃下,当pH为4.0时,溶液中亚硫酸、亚硫酸氢根和亚硫酸根占总浓度的比例分别为0.5%、99.4%和0.1%;当pH为7.4时,已不存在游离亚硫酸,亚硫酸氢根和亚硫酸根的比例分别为61.0%和39.0%;而当pH为12.0时,溶液中已不存在亚硫酸和亚硫酸氢根,亚硫酸根占100%。
2.5自由基链反应引发剂的作用
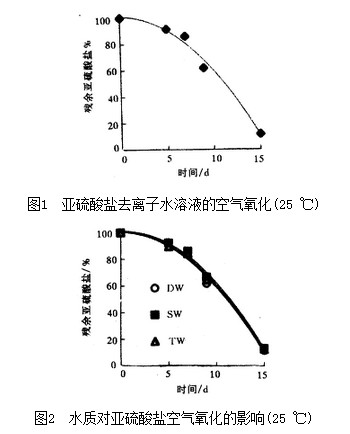
为了考察CSS溶液的贮存效果,试验了加有1.5 mg/L引发剂CuSO4*5H2O的SS溶液在密封不严情况下的氧化情况,其结果见图3。因此,铜离子是SS溶液与氧反应的有效催化剂,铜离子的引入可以加速系统中溶解氧与SS的反应。铜离子也使SS溶液的贮存稳定性有所降低。
2.6自由基吸收剂的作用
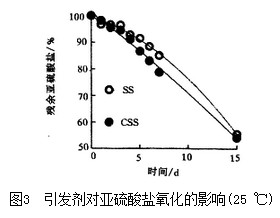
图4示出SS溶液的贮存试验结果。可以看出,自由基吸收剂Vc对SS稳定效果十分显著,经15日空气氧化,SS浓度几乎不变。
3.1关于亚硫酸盐的贮存氧化
实验结果表明,除非隔绝氧气或者采用稳定剂,亚硫酸盐的贮存氧化是不可避免的。在现场加药操作中,人们往往将化学药品提前配成溶液,然后再运往现场使用,溶液的贮存期更长〔5〕。在贮存期内,要做到贮器完全密封是非常困难的,多数现场不具备条件。在这种情况下,亚硫酸盐溶液必然会发生空气氧化而失效。如果将这种溶液仍按原推荐用量加入系统,就必然达不到应有的防腐效果;如果按亚硫酸盐的有效含量加入,就会大大增加系统中硫酸根含量而引起不良后果。因此,贮存期间的自动氧化是亚硫酸盐失效的根本原因。
位于d区的金属,其离子对氧和亚硫酸盐的反应具有催化作用,促进亚硫酸盐的贮存氧化失效(见图3)。
3.2亚硫酸盐失效的防止
根据亚硫酸盐失效的原因,可采用三种防止或减轻失效的方法。1)采用亚硫酸盐防腐时,最好是随用随配;2)当不得不贮存亚硫酸盐溶液时,一定要采用严格的密封措施。对催化亚硫酸盐的贮存,应采取更严格的密封措施;3)采用稳定剂防止亚硫酸盐贮存氧化的技术方案是可行的。稳定剂Vc具有用量小,对亚硫酸盐稳定效果好以及稳定期长等特点,对于工业上广泛存在的难以实现亚硫酸盐现配现用的场合,用稳定亚硫酸盐代替亚硫酸盐是最方便经济的选择。
3.3关于亚硫酸盐的氧化机理
至今,关于亚硫酸盐和氧的反应机理仍未查明。正如PM Wilkinson在1993年指出的那样,各种催化剂对亚硫酸钠氧化速度的影响已经研究了五十多年,尽管如此,已发表的动力学数据仍有许多不尽人意之处,对亚硫酸钠的氧化反应机理还没有完全清楚〔7〕。
实验结果表明,在一定的供氧速度下,亚硫酸钠氧化速度与溶液的pH值、水中存在的钙、镁离子以及普通阴离子等无关,但自由基链反应引发剂Cu2+有催化作用,自由基链反应终止剂Vc有阻滞作用。由此可以证实,亚硫酸盐的氧化是以自由基机理进行的。在试验条件下,自由基链反应可能按下述过程进行。
链引发:O2+SO32-.O2-+.SO3-
链传播:.SO3-+O2.SO5-
.SO5-+SO32-SO52-+.SO3-
中间体反应:SO32-+SO52-2SO42-
链终止:2.SO3-S2O62-(当氧被消耗完时)
加入铜离子催化剂,使自由基生成的速度加快:
Cu2++SO32-Cu++.SO3-
Cu++O2Cu2++.O2-
金属催化剂的性能与结构有着密切的关系,但人们对这一关系的认识,目前尚处于半经验阶段。
稳定剂Vc是有机高分子物质,分子中含有活泼羟基基团。在亚硫酸盐溶液中,这些基团优先吸收在链引发步骤中产生的自由基,生成较稳定的链终止产物:
RCH2OH+.SO3-RCH2O.+HSO3-
RCH2O.+.SO3-RCHO+HSO3-
由于上述反应的进行,使自由基链传播中断,氧化反应几乎不能发生。
1)关于亚硫酸盐防腐效果有时不佳的原因主要是由于亚硫酸盐的贮存氧化失效。在实验条件下,亚硫酸盐因贮存而自动氧化的量占99.93%,起有效防腐作用的量仅占0.07%。水质和pH值等条件对亚硫酸盐的贮存氧化几乎没有影响,铜离子等d区元素则有促进作用。
2)亚硫酸盐的空气氧化按照自由基反应机理进行,这可由下述实验事实证实:典型的链反应引发剂能有效地催化亚硫酸盐和氧的反应,典型的自由基吸收剂能终止反应。
3)稳定亚硫酸盐可从自由基吸收剂制得。在模拟工业现场条件下进行的一系列试验结果表明,稳定亚硫酸盐具有很好的贮存稳定性,它能够方便、经济、有效地解决亚硫酸盐的氧化失效问题。
[1]鲍其鼐.工业水处理,1994;14(2):4
[2]GB 1576—1996
[3]Uhlig H H. Corrosion and Corrosion Control,1985:278
[4]Lunden K C. Corrosion, 1986:180
[5]US 3899293
[6]熊蓉春.管道技术与设备,1995;(5):8~12
[7]Wilkinson P M. Chemical Engineering Science, 1993;48(5):933~941
作者简介:第一作者熊蓉春,1944年生,1967年毕业于兰州大学工作,现在北京化工大学,副教授。
作者单位:北京化工大学(北京,100029)